Ictus
“Ictus” è una parola latina che significa letteralmente “colpo” (in inglese “stroke”) e sta a sottolineare la modalità di esordio di questa sindrome che è, appunto, improvviso come un colpo.
Tra le patologie di tipo neurologico, quelle cerebrovascolari sono in assoluto le più frequenti. Nella popolazione dei paesi più sviluppati costituiscono la terza causa di morte (dopo le malattie cardiovascolari e i tumori) e la prima causa di invalidità. La loro incidenza aumenta in modo esponenziale con l’età.
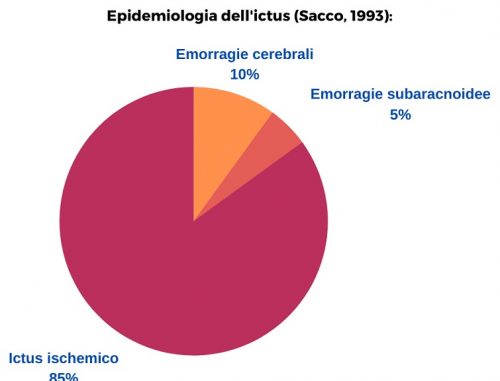
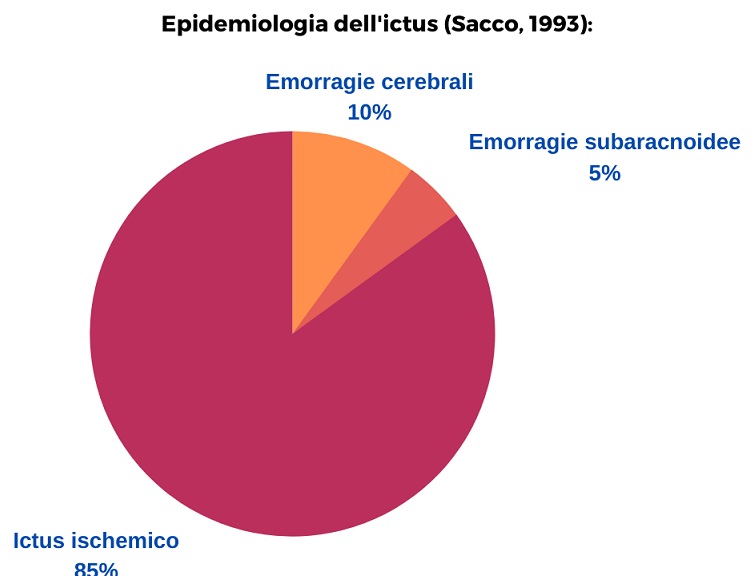
Possiamo distinguere due tipologie principali di ictus: ischemico ed emorragico. L’ictus emorragico prevedere poi una sottocategoria che è rappresentata delle emorragie subaracnoidee.
Epidemiologia (Sacco 1993):
ICTUS ISCHEMICO
La causa dell’ictus ischemico è da imputare ad un insufficiente apporto ematico in una determinata area del cervello (ischemia focale). La caranza di sangue in quest’organo comporta quadri clinici neurologici diversi a seconda della sua localizzazione. Se questa carenza/assenza supera una certa durata temporale, si struttura un danno tissutale irreversibile (ictus ischemico o infarto cerebrale).
In base alla durata dei sintomi possiamo distinguere principalmente tre tipologie di eventi vascolari ischemici: Attacco Ischemico Transitorio (TIA); Reversible Ischemic Neurological Attack (RIND); Ictus.
Se la durata dei sintomi è inferiore alle 24 ore si parla di Attacco Ischemico Transitorio (TIA: Transient Ischemic Attack). Fazio e Loeb (Fazio-Loeb 2009) fanno notare che questa denominazione è fortemente confusiva perchè in realtà sembra che 1/3 dei pazienti con TIA in realtà presentano segni di danno cerebrale alla diagnostica per immagini, nonostante la completa remissione dei sintomi. I pazienti che hanno avuto un TIA sono soggetti ad un aumento del rischio di incorrere in un ictus ischemico che, nel primo anno dopo il TIA si assesta intorno al 10% per poi scendere al 5% annuo. Il 30% di questi pazienti va incontro ad altri TIA. La percentuale di rischio è maggiore nei soggetti con più di 65 anni.
Se la durata dei sintomi è superiore alle 24 ore ma inferiore a tre settimane l’episodio prende il nome di RIND (Reversible Ischemic Neurological Attack).
Se i deficit neurologici persiostono si parla di ictus. La persistenza dei deficit neurologici è dovuta all’irreversibilità del danno parenchimale causato dalla prolungata ischemia.
Sintomi di esordio più frequenti dell’ischemia cerebrale sono:
– Difficoltà nell’eloquio (disartria, afasia)
– Deficit di forza o di sensibilità in un emilato del corpo
– Disturbo della coordinazione (atassia)
– Cefalea
– Disturbi visivi (amaurosi, emianopsia laterale, diplopia)
– Vertigini / sbandamenti
Di norma l’esordio avviene durante il giorno, con maggior incidenza al risveglio o nelle prime ore del pomeriggio.
I deficit neurologici possono avere andamenti diversi: possono essere completi e stabili fin dall’inizio, manifestare con modalità ingravescente o tendere ad un miglioramento. Segni e sintomi che vengono riscontrati all’esame neurologico danno modo di ipotizzare con un buon margine di probalità la sede della lesione, che corrisponde al territorio di distribuzione del vaso che è andato incontro ad occlusione o a ridotta perfusione. In particolare vengono distinte tre sindromi: del circolo anteriore o carotideo; del circolo posteriore o vertebrobasilare; lacunare.
La circolazione cerebrale è strutturata in modo tale che, in caso di ostruzioni di una delle principali arterie (carotidi e vertebrali) che conducono il sangue al cervello, il suo apporto all’intero organo sia comunque garantito: queste arterie confluiscono in un anello arterioso, il circolo o poligono di Willis, da cui il sangue viene distribuito a tutto il cervello.
Sindrome del circolo anteriore o carotideo
Grazie al circolo di Willis, l’ostruzione di una arteria carotide interna può risultare asintomatica. In alcuni casi questo prezioso sistema di compenso riesce ad ammortizzare addirittura un’occlusione bilaterale di entrambe le carotidi interne. Non sempre però (per diversi motivi) questo sistema è in grado di svolgere la sua funzione. Se il circolo di In questo caso si verifica un’ischemia del circolo carotideo che, a seconda della sua importanza, può manifestarsi con diversi quadri clinici che possono presentarsi in diverse combinazioni:
- emiparesi/emiplegia controlaterale (nel lato opposto del corpo rispetto a quello dell’insulto cerebrale) che può coinvolgere arto superiore, arto inferiore, volto;
emianopsia laterale omonima controlaterale;
afasia per le ischemie dell’emisfero sinistro;
deviazione forzata dello sguardo verso il lato in cui si è prodotta l’ischemia (si dice che il paziente “si guarda la lesione”);
neglect ed altri sintomi di tipo cognitivo (emisomatoagnosia, anosognosia, anosodiaforia) per le ischemie a carico dell’emisfero destro (da notare che in una piccola pecentuale della popolazione la dominanza emisferica è invertita tra destra e sinistra);
disturbi della coscienza
nausea, vomito, emiatassia, disartria, nistagmo
Sindrome del circolo posteriore o vertebrobasilare
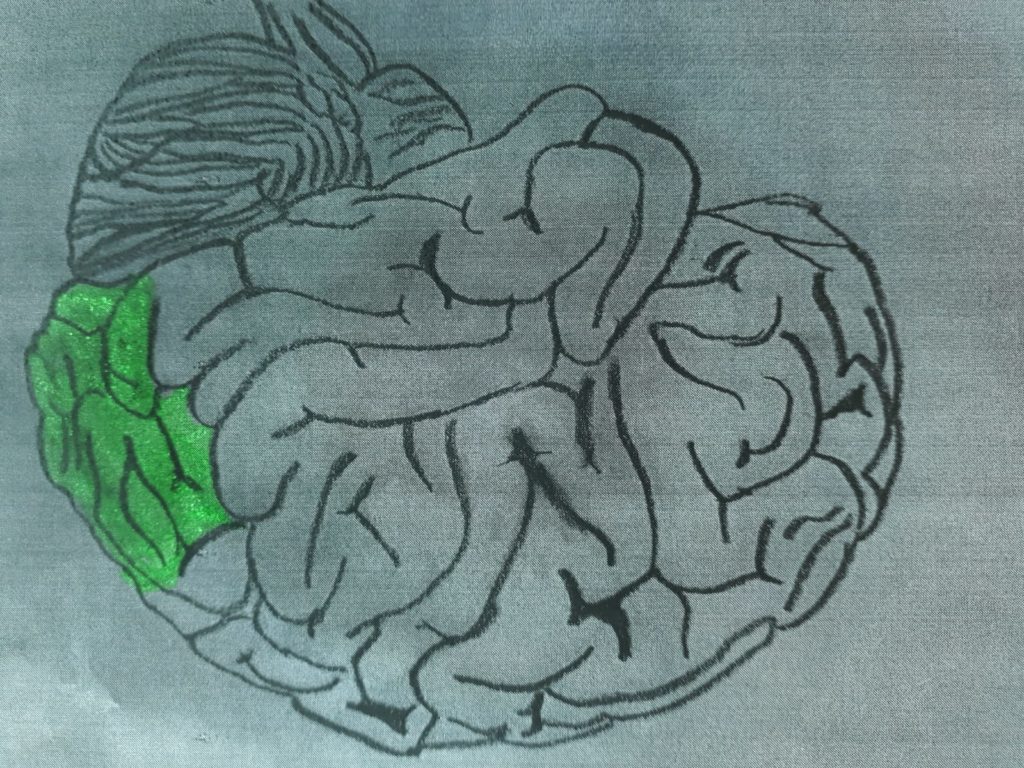
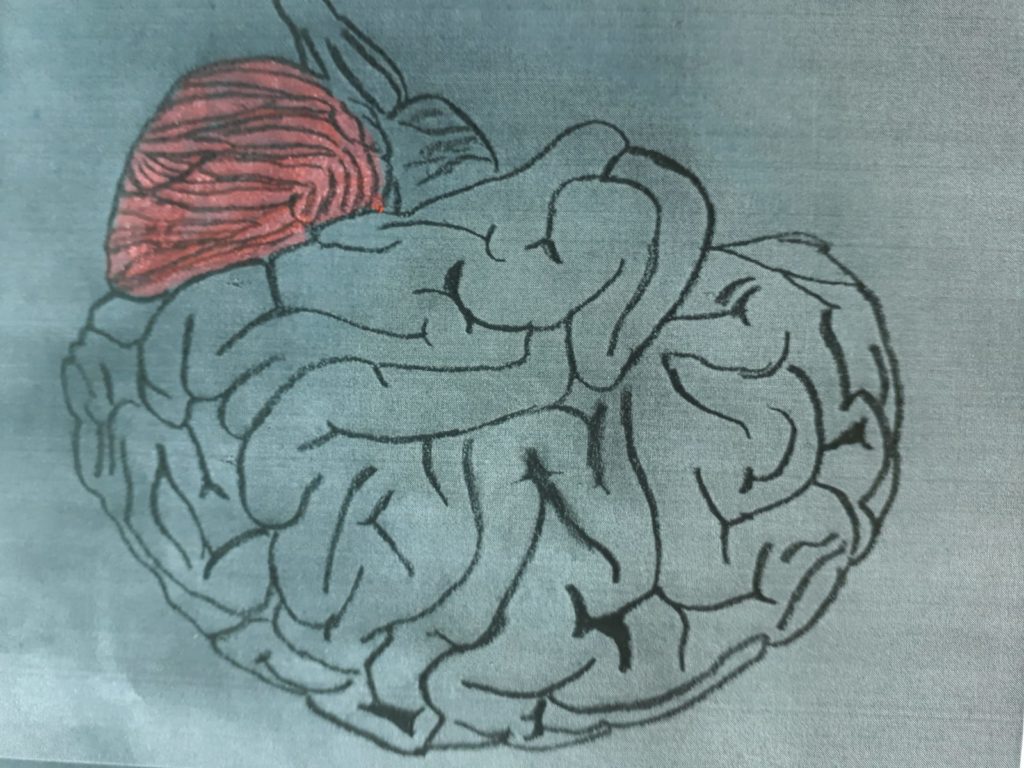
Questa sindrome comporta che l’insulto ischemico possa coinvolgere il lobo occipitale, il talamo, il cervelletto e il tronco encefalico.

La sintomatologia, in base all’estensione della lesione, può comportare una molteplice varietà di sintomi di diversa tipologia:
visivi (lobo occipitale)
motori e sensitivi: emisindrome sensitivo-motoria controlaterale (lobo occipite).
cognitivi di tipo visuo-spaziale (lobo occipitale; lesioni talamiche maggiori)
paralisi bilaterale del III nervo cranico (ischemia bilaterale di talamo e mesencefalo)
tetraparesi (ischemia bilaterale di talamo e mesencefalo)
afasia (lesioni talamiche maggiori dell’emisfero sinistro)
disturbi di coscienza, allucinazioni visive, amnesia (lesioni talamiche maggiori)
disartria (cervelletto)
emi-atassia cerebellare omolaterale alla lesione (cervellettto)
anestesia termo-dolorifica controlaterale alla lesione (cervelletto)
vertigini, nistagmo (cervelletto)
paresi facciale periferica (cervelletto)
quadro clinico da ischemia del tronco encefalico, generalmente non compatibile con la vita.
Si tratta di piccole ischemie rotondeggianti (da mezzo centimetro ad un centimetro e mezzo) che si manifestano nel percorso terminale di alcune arterie. Solitamente non sono sintomatiche perché si verificano in aree del cervello che non producono una sintomatologia clinica in caso di lesione. In alcuni casi però, se si localizzano in aree strategiche del cervello, possono determinare sintomatologie anche molto rilevanti come ad esempio un’emiparesi.
FATTORI DI RISCHIO


I fattori di rischio dell’ictus ischemico vengono distinti i due gruppi principali. Quelli “non modificabili” e “modificabili”. Questi ultimi vengono ulteriormente distinti in due ulteriori gruppi, in base al fatto che il rischio a loro attribuito sia certamente documentato o meno:
Fattori di rischio non modificabili:
– Età
– Sesso
– Familiarità
– Etnia
Fattori di rischio modificabili certamente documentati:
– Ipertensione
– Cardiopatie
– Fumo di sigaretta
– Diabete
– Iperomocisteinemia
– Ipoertrofia ventricolare sinistra
– Stenosi carotidea asintomatica
Fattori di rischio modificabili non completamente documentati:
– Ipercolesterolemia
– Uso di contraccettivi orali
– Abuso di alcool e droghe
– Obesità
– Emicrania
– Ematocrito elevato
– Ispessimento medio-intimale della carotide
EZIOLOGIA DELL’ICTUS ISCHEMICO:
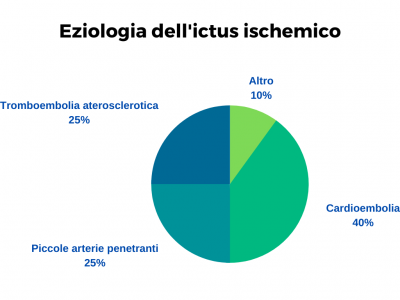
– Tromboembolia aterosclerotica (20-25% dei casi di ictus ischemico). Si verifica a causa di complicazioni delle lesioni aterosclerotiche dei grossi vasi epiaortici, dell’arco aortico e delle grandi e medie arterie intracraniche: le placche aterosclerotiche possono dare luogo a trombi che limitano o occludono il lume del vaso, o emboli che si distaccano dalla placca e vanno ad occludere il vaso a valle la dove il suo lume diminuendo ne blocca il passaggio.
– Cardioembolia (40% dei casi di ictus ischemico). Può originare dall’atrio sinistro del cuore per la formazione di trombi in questa sede dovuti ad un rallentamento del flusso sanguigno al suo interno (in particolar modo nell’auricola) che poi portano al distacco di emboli quando si viene a creare una maggior turbolenza del flusso (come nel caso della fibrillazione atriale intermittente); dalle valvole cardiache quando queste sono andate incontro a processi patologici; dal ventricolo sinistro; più raramente dalle vene polmonari, per processi legati a patologie oncologiche con sede polmonare.
– Patologie a cerico delle piccole arterie penetranti del cervello dovuta ad ipertensione e diabete. (10-25% dei casi di episodi ischemici cerebrali). L’occlusione di queste arterie causa dei piccoli infarti lacunari. Si tratta di lesioni che variano da 2 a 20 millimetri. Vengono riassorbite dai macrofagi (sorta di “cellule spazzine”) e lasciano come esito delle piccole cavità. In genere gli infarti lacunari si verificano nelle profondità degli emisferi cerebrali e nel tronco encefalico. Si manifestano in due forme cliniche principali. Sensitiva pura (nelle lesioni che coinvolgono il talamo) e motoria pura (quando le lesioni interessano la capsula interna o la piramide del bulbo cerebrale).
PREVENZIONE
La prevenzione primaria (il cui obiettivo e limitare le probabilità che una persona che non è mai andata incontro ad episodi di ictus ne sia colpita) consiste nell’intervenire sui fattori di rischio modificabili come il fumo di sigaretta, il consumo di alcool, la diminuzione del consumo di sale nella dieta, la pratica di una moderata attività fisica, il trattamento farmacologico dell’ipertensione e del diabete.




TRATTAMENTO DELL’ICTUS ISCHEMICO
La svolta nel trattamento dell’ictus ischemico è stata determinata dalla costituzione delle Stroke Units e dall’impiego della trombolisi.
E’ stato appurato che il trattamento del paziente con ictus nelle Stroke Units riduce sensibilmente sia la mortalità (di circa il 20%) che gli esiti in termini di disabilità nei pazienti con ictus (Candelise et al., 2007). Le Stroke Units sono reparti ospedalieri con personale medico, infermieristico e riablitativo con formazione specifica per il trattamento di pazienti con ictus. Tra i motivi della maggior efficacia dei trattamenti nelle Stroke Units, vi è anche il fatto che questi reparti sono dotati di fisioterapisti specializzati in neuroriabilitazione che assicurano un intervento precoce e altamente qualificato ai pazienti, a partire dal posizionamento che, come vedremo in seguito, ha un ruolo fondamentale nella prevenzione dell’instaurarsi delle limitazioni funzionali ma anche di complicanze come le temute piaghe da decubito.
Per quanto riguarda la trombolisi, possiamo certamente affermare che attualmente è il trattamento farmacologico più diffuso per la fase iper-acuta dell’ictus. Il suo impiego non soltanto ha modificato sensibimente in positivo le possibilità di sopravvivenza di questa tipologia di pazienti ma anche il grado di disabilità residua. La sua efficacia è però vincolata al rispetto dei criteri di esclusione che individuano i pazienti per i quali è controindicata, e al fatto che venga somministrata non oltre le 4 ore e mezza dall’ictus. L’obiettivo della trombolisi è la disostruzione dell’arteria occlusa con ripristino della circolazione sanguigna la dove era venuta a mancare. Il principale fattore di rischio della trombolisi è l’insorgenza di emorragie cerebrali.
Prognosi
Nei primi 30 giorni dall’ictus la mortalità in media si attesta tra il 10 e il 15%. Il 30-40% dei pazienti sopravvissuti ha degli esiti di invalidità.
LA RIABILITAZIONE
La riabilitazione di pazienti con danno cerebrale dovuto ad ictus ischemico ed emorragico (emorragia cerebrale ed emorragia sub-aracnoidea), traumi cranici, prevede una prima modalità di intervento nella fase acuta, quando il paziente è ricoverato in terapia intensiva o nella stroke unit.
Superata la fase acuta poi, la neuroriabilitazione potrà essere orientata al trattamento più specifico dei diversi esiti:
- emiplegia (compresa la paresi facciale)
- deficit dei muscoli oculomotori
- disturbi del linguaggio e delle funzioni corticali superiori
- disturbi della deglutizione
ICTUS EMORRAGICO
Epidemiologia
L’ictus emorragico a livello epidemiologico costituisce il 15% degli ictus. La mortalità, rispetto all’ictus ischemico, è più elevata attestandosi tra il 35-52% entro i primi 30 giorni dall’evento, di cui la metà entro i primi due giorni. Inoltre, soltanto il 20% dei sopravvissuti riesce a raggiungere una condizione fisica e mentale che gli consenta una vita indipendente (Steiner et al; 2006; Broderick et al; 2007).
Patogenesi
L’ictus emorragico può essere causato dalla rottura di un vaso, di un aneurisma congenito, di una Malformazione Artero-Venosa (MAV)f o di un cavernoma.
Si verifica più frequentemente nelle regioni profonde del cervello o del cervelletto, in soggetti ipertesi. Queste tipologia di emorragia cerebrale viene definita “profonda” o “a sede tipica” (ictus a sede tipica). Quando l’emorragia si verifica nella sostanza bianca sottocorticale, in uno dei due lobi del cervello, prende il nome di emorragia lobare o “a sede atipica” (perchè si presenta più raramente rispetto alla precedente).
Entrambe le tipologie esordiscono solitamente di giorno con deficit neurologici che peggiorano in pochi minuti/ore. Spesso compaiono disturbi della coscienza e sintomi da ipertensione endocranica come mal di testa e vomito. Una differenza abbastanza netta con l’ictus ischemico e l’emorragia subaracnoidea (di cui parleremo più avanti), è proprio il veloce aggravamento del quadro clinico, modalità che in queste altre tipologie è piuttosto rara. Esistono però anche casi, rari, in cui l’ictus emorragico evolve in maniera asintomatica.
Ictus a sede tipica (emorragia profonda o a sede tipica)
L’emorragia a sede tipica è dovuta alla rottura delle arteriole perforanti di calibro minore che, sollecitate meccanicamente dall’ipertensione, sviluppano delle dilatazioni fusiformi che vanno poi in contro a fissurazione. Le localizzazioni più colpite sono i nuclei della base (in particolar modo il putamen e il pallido) con coinvolgimento della capsula interna, il talamo, il ponte e il cervelleto.
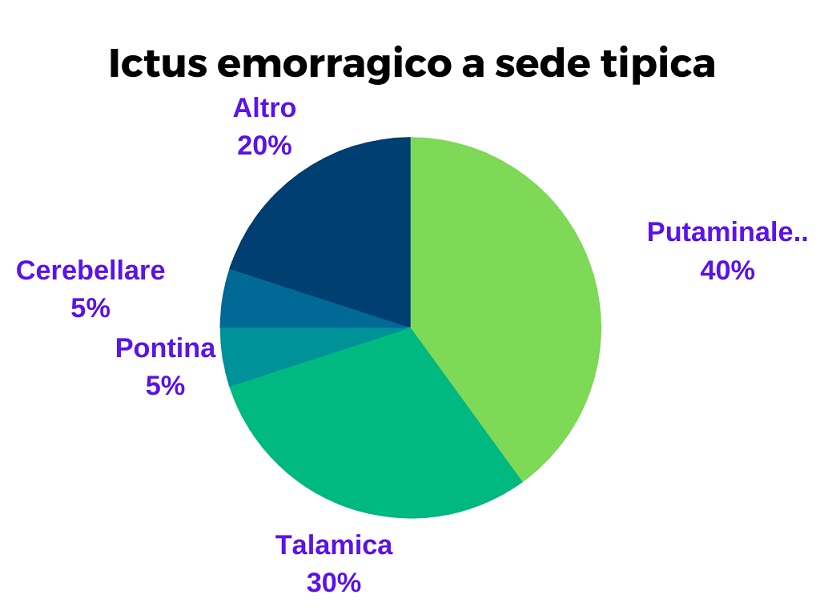
Il quadro d’esordio delle forme che conivolgono i nuclei della base e la capsula interna è per lo più è caratterizzato da un’emiplegia facio-brachio-crurale che colpisce l’emilato opposto a quello della lesione cerebrale. In molti casi è presente una deviazione dello sguardo e una rotazione del collo verso il lato del cervello in cui si è verificata la lesione. In un terzo dei casi il paziente poi entra in coma. Quando l’emorragia è importante finisce per coinvolgere il sistema ventricolare. Questa evenienza comporta sintomi come cefalea, vomito e rigidità nucale dovuti ad irritazioni delle meningi e all’ipertensione intracranica che si sviluppa a causa del coinvolgimento del sistema ventricolare e della massiva emorragia.
Nelle lesioni a carico dei nuclei talamici, di piccola entità, possono presentarsi disturbi della vista (emianopsia laterale omonima) neglect (per le lesioni dell’emisfero destro) o disturbi del linguaggio (afasia fluente). Questi deficit nella maggior parte dei casi regrediscono poi spontaneamente. Quando il danno in questa sede è di entità maggiore c’è la possibilità che venga compromessa la capsula interna e che coerentemente si verifichi un’emiplegia dal lato opposto alla lesione cerebrale. Il danno può estendersi anche a strutture limitrofe al di sotto del talamo o al mesencefalo comportando una sintomatologia a carico dei muscoli intrinseci ed estrinseci degli occhi.
Se l’emorragia si verifica a livello del ponte, nei casi più gravi può comportare tetraplegia e coma profondo. Nei casi meno gravi la sintomatologia può variare ampiamente comprendendo diversi tipi di deficiti sia motori che sensitivi bilaterali o/e compromissione dei nervi cranici, ma solitamente non compare compromissione della coscienza.
Quando l’emorragia coinvolge il cervelletto (emorragia cerebellare) si presenta all’esordio con improvvisa cefalea a livello della nuca, vomito, vertigini ed atassia dallo stesso lato della lesione. Spesso compare una deviazione dello sguardo dal lato opposto alla lesione cerebrale. Nella maggior parte dei casi la coscienza non è compromessa.
Prognosi
Il 30% dei pazienti muore entro un mese dall’ictus, di cui la metà entro i primi giorni. La compromissione dello stato di coscienza e l’entità della lesione sono fattori predittivi importanti.
Ictus a sede atipica (emorragia lobare o a sede atipica)
Ha una prognosi migliore rispetto all’icuts a sede tipica. Si verifica tra la corteccia cerebrale e la sostanza bianca sotto forma di ematomi di forma ovaleggiante. I lobi cerebrali colpiti sono, in ordine di probabilità, il parietale, l’occipitale, il frontale e il temporale. La sintomatologia, come in tutti i danni cerebrali, dipende dalla sede in cui si verifica l’emorragia. L’andamento clinico in fase acuta presenta un susseguirsi di peggioramenti in relazione a nuovi eventi di sanguinamento.
EMORRAGIA SUBARACNOIDEA (ESA)

Si verifica ………………… Solitamente è dovuta alla rottura di aneurismi o malformazioni vascolari ma può avere anche cause traumatiche (trauma cranico). A volte è la conseguenza di estese emorragie cerebrali che coinvolgono ….
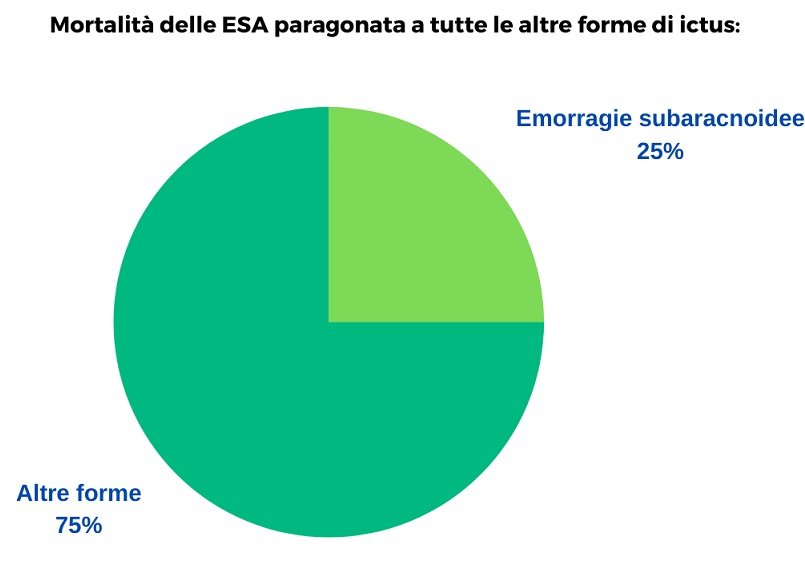
La percentuale di emorragie sub-aracnoidee è molto bassa rispetto alle altre forme di ictus ma l’alta mortalità che le caratterizza le rende responsabili del 25% tra tutte le morti per ictus, di qualsiasi tipologia.
Idrocefalo
Definizione del 1978 del WHO (Whorld Health Organization)
Sacco, R.L., 1993, Ischemic stroke is predictable and preventable. New York State,
Neurologia di Fazio-Loeb. Società Editrice Universo. 2009
Candelise et al., 2007; Stroke Unit Trialists’ Collaboration, 2007)